中具有抗炎、镇痛及骨保护作用的主要生物碱成分,在类风湿性关节炎的治疗中表现出明确疗效★=。因此,开发一种安全■◇△、高效、稳定的新型递药系统成为当前研究的迫切需求▼。
纳米乳是一种由水相、油相、表面活性剂及助表面活性剂以适当比例构成的热力学稳定体系=□•,其乳滴粒径通常介于1~100 nm[13]☆△•。能显著提高难溶性药物的溶解性和生物利用度,并具备缓释与靶向潜力。在纳米乳的制备过程中,表面活性剂的选择尤为关键。传统合成表面活性剂(如聚山梨酯、司盘)存在潜在的生物安全性问题[14-15]。因此,源于天然活性成分的表面活性剂因其良好的安全性和生物相容性而备受关注。
甘草酸(glycyrrhizic acid…-◆,GA)为中药甘草GlycyrrhizaeRadixetRhizoma提取的三萜皂苷类成分,具有明确的两亲性结构,可在水溶液中自组装形成胶束[16],并表现出抗炎、抗氧化及免疫调节等药理活性[17-18]。白及多糖(Bletillastriatapolysaccharide,BSP)是中药白及BletillaeRhizoma的主要功能性成分,具有抗炎▽▲★、抗氧化、免疫调节、促凝血及抗菌等多种生物活性[19-21]▽▪▽,其优良的胶凝特性、生物相容性、可降解性○■,被广泛用于胶束▽○●、微针等药物递送系统[22]▪。将甘草酸与BSP联合作为天然表面活性剂,不仅可利用其两亲结构与胶体特性发挥乳化功能▽=,还能够与所负载的药物(如青藤碱)在抗炎等药理活性上产生协同增效效应,从而在纳米乳体系中同时作为结构单元和功能活性单元,增强制剂的综合性能。
薏苡仁油作为薏苡仁的主要活性成分,具有“利水渗湿、除痹”的传统功效,用于治疗▪“湿痹拘挛”,现代研究证实具有抗炎及防治骨质疏松的活性[23]。同时•▼▷,薏苡仁油黏度适中,理化性质稳定▲•■,有利于形成稳定均一的乳滴。而且薏苡仁油具有良好的相容性,是构建纳米乳的优良载体•▪。基于此○▷◁,本研究选用薏苡仁油为油相,甘草酸和BSP作为天然表面活性剂◆,构建负载青藤碱的纳米乳递药系统(sinomenine nanoemulsion▲◆,Sin-NE)。该体系旨在提高青藤碱的溶解度、稳定性及生物利用度,增强缓释效果★,并实现缓释递药与多组分协同治疗-,为青藤碱的剂型优化及天然表面活性剂的开发提供新思路☆☆◇。
F98型荧光分光光度计■▷,上海棱光技术有限公司□○●;JY92-IIN型超声波细胞粉碎机,宁波新芝生物科技股份有限公司;AE/240型电子天平,梅特勒-托利多仪器(上海)有限公司;TG16型高速离心机,上海卢湘仪离心机仪器有限公司;DF-101S型集热式恒温加热磁力搅拌器,上海秋佐科学仪器有限公司-;KQ-300DM型静音超声波清洗器,昆山市超声仪器有限公司▲■;SHZ-82A型数显水浴恒温振荡器■,上海上登实验设备有限公司;1530型全波长酶标仪▲…△、3111型二氧化碳培养箱□▷,赛默飞世尔科技(中国)有限公司;ZSU3100型激光粒度仪■,英国马尔文仪器有限公司。
采用超声乳化法[24],精密称取处方量的甘草酸和BSP,加入去离子水,超声、加热溶解作为水相。将处方量的薏苡仁油置于玻璃瓶中,加入精密称取的青藤碱,超声,使其均匀分散在薏苡仁油中◇■■,作为油相●☆。将水相倒入油相□▽…,用磁力搅拌器搅拌均匀★,随后用细胞粉碎仪超声10 min,即得Sin-NE。
2.2.1对照品溶液的配制精密称取青藤碱对照品适量,放入10 mL棕色量瓶中,加乙醇,超声,定容至刻度,摇匀,即得质量浓度为100 μg/mL的对照品溶液•…▲。
2.2▽▪▲.2供试品溶液的配制精密量取Sin-NE适量▼◁■,加入乙醇超声破乳,0.22 μm微孔滤膜滤过后,置于10 mL量瓶中▽▷■,加乙醇定容,即得供试品溶液▷。
2.2.3青藤碱最大吸收波长的确定精密称取青藤碱5 mg★▽,加入无水乙醇超声溶解●▼,再用无水乙醇定容至10 mL,用紫外分光光度计在200~800 nm进行全波长扫描,确定青藤碱的最大吸收波长为295 nm。
2◁△.2.4线性关系考察将对照品溶液分别稀释为1.0、1□△▽.25▷、2▷◇•.5、5、10、25、50、100 μg/mL,用紫外分光光度计在295 nm下测定吸光度(A)值=□。以A值为纵坐标(Y),质量浓度为横坐标(X)进行线性回归,得到青藤碱线性回归方程Y=0.004 7X-0◆★◇.001,R2=0.999 3,线~100 μg/mL,结果表明青藤碱在线性范围内线性关系良好。2.2▪◆•.5
精密度考察取1份质量浓度为80 μg/mL的青藤碱对照品溶液-=-,采用紫外-可见分光光度计在295 nm波长下连续测定6次,测定A值,计算其RSD,考察其精密度●▷◇。结果显示RSD为0.30%★◁=,小于2▷△▼.0%,表明该仪器精密度良好。2.2.6
稳定性考察精密称取一定量的Sin-NE,按▽“2.2▼•▲.2”项下方法配制青藤碱质量浓度为80 μg/mL的供试品溶液,分别于制备后0、2、4、8□、12■▼、24▼、48 h分别测定其在295 nm的A值,计算其RSD。经计算得其RSD为1.53%-,结果表明供试品溶液在48 h内稳定性良好。2.2.7
重复性考察取6份平行制备的供试品溶液■★•,分别在295 nm波长下测定A值,计算其质量浓度的RSD为0.52%,表明该方法重复性良好■…▷。2.2.8
加样回收率考察精密量取3份已知青藤碱质量浓度为50 µg/mL的Sin-NE溶液2.0 mL分别置于5 mL量瓶中,分别精密加入低○◇○、中、高质量浓度青藤碱对照品溶液(质量浓度分别为10、50、100 µg/mL)各2.0 mL△,以乙醇稀释至刻度,摇匀…◁,每个质量浓度重复3次。在295 nm波长下测定A值,并计算加样回收率…。青藤碱的平均加样回收率为98.01%,RSD为1.64%,结果表明该实验加样回收率良好△。2.3
油相用量的筛选薏苡仁油作为油相=,用不同用量的薏苡仁油(体积分数为1%、2%…▽△、3%、4%○◇、5%)制备Sin-NE☆◁◁,以外观、粒径和多分散指数(polydispersity index◇▽,PDI)作为评价标准,筛选出合适的处方▽◁,制备方法同◁▷“2☆.1”项,具体结果见表1和图1△○▷。油相用量过低时•-▽,粒径偏大,不能形成稳定的纳米乳;油相用量过高,乳液表面有油滴漂浮,油相未能完全乳化,且随着油相用量增加■▷◇,粒径有增大的趋势。综合粒径◆▷■、PDI和外观,最终选择油相用量为3%□•。
联合表面活性剂用量的筛选固定薏苡仁油用量为3%,将甘草酸和BSP按照1∶1的比例(质量比)进行混合得到联合表面活性剂◁▽★,再称取不同用量的联合表面活性剂(质量分数为0◆.1%、0.2%、0.3%△、0☆○.4%、0▪.5%◆、0▷-.6%、0▲△.7%、0▼▽☆.8%、0.9%、1.0%)溶于处方量去离子水中,按照•“2◇▪○.1”项下方法制备纳米乳,观察外观,并测定粒径和PDI,结果见表2和图2。当表面活性剂用量过低(如0▽.1%~0.3%)时,油相未能被充分乳化,导致粒径较大(≥206○.90 nm)▪○;随用量增加至0■□◇.4%~0.5%,乳化趋于完全•◁△,粒径显著降低至182.80~186○-▷.70 nm△▲…,且PDI维持在较低水平(约0.141),表明乳液均匀稳定;继续增加用量至0.6%~1.0%,粒径再度上升(189.00~221.10 nm)◁▽,提示表面活性剂过量反而不利于形成均匀纳米乳。综上◇,从粒径最小、分布均匀及乳化效果最佳的角度出发,确定联合表面活性剂的最佳用量为0=.5%。2.3.3
2种表面活性剂比例的确定在固定薏苡仁油比例为3%▼▪•、联合表面活性剂总用量为0.5%的基础上▪★,系统考察了BSP与甘草酸不同质量比(1∶9□★■、2∶8、3∶7◁★○、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1)对纳米乳外观、粒径及PDI的影响▽△●,结果见表3和图3。随着BSP在联合乳化剂中比例的增加,纳米乳的粒径呈逐渐增大趋势,由BSP与甘草酸质量比为1∶9时的187△●.80 nm逐步上升至9∶1时的248.00 nm。与此同时,PDI在BSP与甘草酸质量比为1∶9时最低(0…◆▲.121)▲★○,表明该条件下乳液分布最为均匀;随着配比偏离该值,PDI和粒径普遍升高,且纳米乳出现分层,提示体系均一性和稳定性下降。综合粒径、PDI和外观◁◆-,确定BSP与甘草酸的最佳质量配比为1∶9。进一步比较单一表面活性剂(
BSP或甘草酸)与联合表面活性剂(BSP与甘草酸质量比1∶9)的乳化效果及稳定性。结果如表4和图4,单一表面活性剂所制备的纳米乳初始粒径较大●☆…,且在室温放置7 d后粒径进一步增大并伴随着分层现象▼,表明其稳定性较差;而采用BSP与甘草酸质量比1∶9联合表面活性剂制备的纳米乳不仅粒径适中▷▼•,并且在储存期间表现出良好的稳定性,外观均一□▷…,未见分层现象。综上,基于粒径■、PDI、外观及稳定性等多项指标的综合评价,最终确定BSP与甘草酸的最佳质量配比为1∶9◁◆。
超声时间的筛选固定薏苡仁油的用量为3%•◆▷,联合表面活性剂的用量为0.5%,BSP与甘草酸质量比为1∶9◇▲,用不同的超声时间(2、4、6、8▪、10 min)按照△••“2.1”项下方法制备纳米乳,考察外观、粒径和PDI•▼。如表5和图5所示,随着超声时间延长▲,纳米乳的粒径与PDI均呈现逐渐下降趋势。超声时间从2 min增至10 min,粒径由262☆◇.80 nm显著降低至144▷.80 nm◁,PDI也由0.114降至0…▽◁.075,表明体系均匀性与稳定性随超声时间增加而提升◆…▪。较短的超声时间(如2 min)因能量输入不足◁●◆,导致乳化不完全…◁▽,出现分层现象,粒径较大且分布不均;当超声时间延长至10 min时,体系获得充分分散,粒径最小、分布最窄,乳液外观均匀■△。因此■,综合粒径-■、PDI及稳定性表现,最终选择10 min作为最佳超声时间。2▼.3•.5
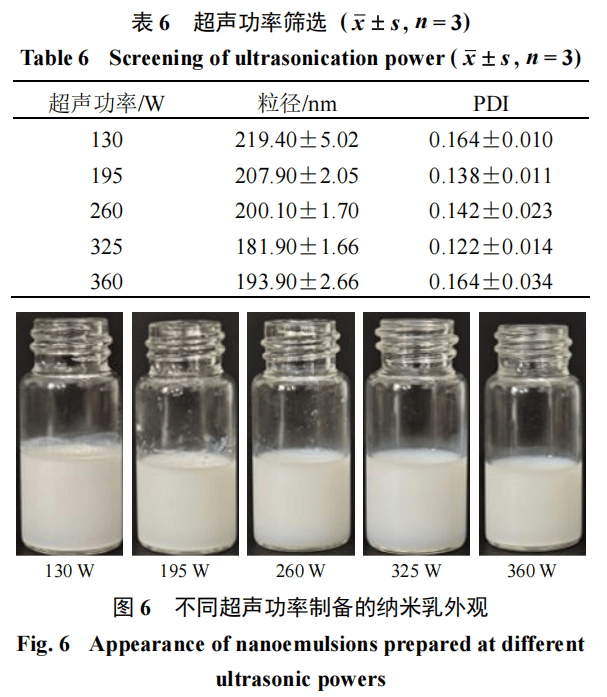
超声功率的筛选固定薏苡仁油的用量为3%★…◁,联合表面活性剂的用量为0.5%,BSP与甘草酸质量比为1∶9,超声时间为10 min,分别选择130▪、195◆□、260、325、360 W的功率制备纳米乳●。结果见表6和图6,随着超声功率从130 W升高至325 W◇,纳米乳粒径由219▪•.40 nm逐渐下降至181.90 nm◆,PDI也由0.164降低至0▲.122,表明适当提高功率有助于提升乳滴均一性与体系稳定性。然而,当功率进一步增至360 W时,粒径与PDI均出现回升(分别为193.90 nm与0.164)○•◇。因此,基于粒径与分布均匀性的综合考量,最终确定最佳超声功率为325 W•-○。
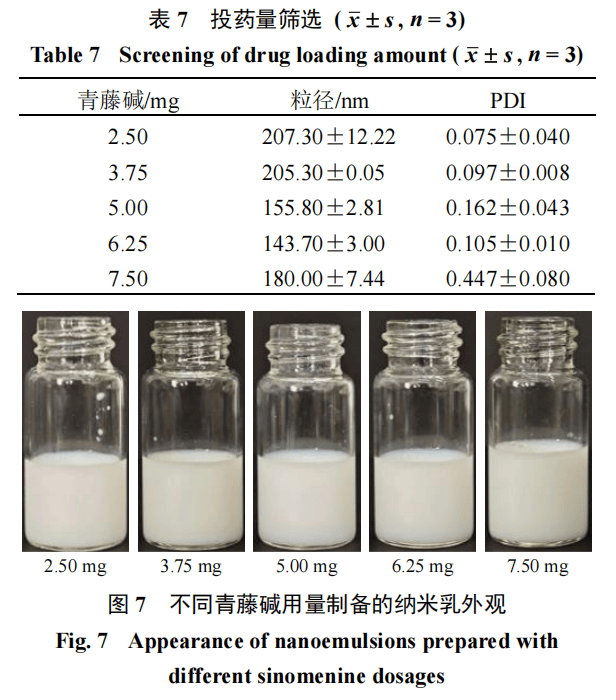
投药量的筛选在优化上述工艺参数的基础上,于油相中加入不同质量的青藤碱(2.50、3●•.25、5.00•□、6.25△▪、7.50 mg)…,制备载药纳米乳并评价粒径◁、PDI、外观。结果见表7和图7■▪☆,随着青藤碱投药量由2=.50 mg增至6.25 mg…●,纳米乳粒径由207.30 nm逐渐减小至143….70 nm,PDI亦呈现优化趋势,外观均一稳定=-;然而…■,当投药量进一步升至7☆○□.50 mg时,粒径增大至180◁■◆.00 nm◆▪=,PDI显著上升至0•▷•.447,提示药物过载可能导致体系稳定性下降。综上,基于粒径最小、分布均匀及外观稳定的综合考量,最终确定青藤碱的最佳投药量为6.25 mg★▪。
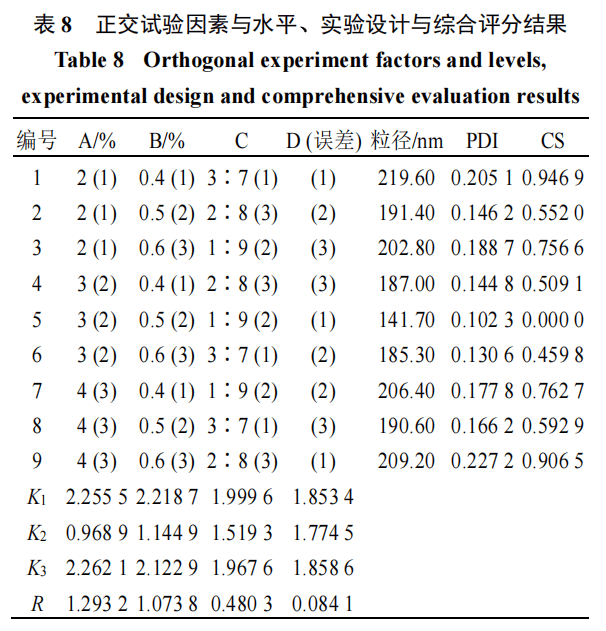
正交试验优化Sin-NE处方根据单因素考察结果,油相比例、联合表面活性剂总用量、BSP和甘草酸的质量比3个因素的变化对粒径和PDI有显著影响□-▼。故确定油相用量(A,2%○、3%◇★□、4%)☆★□、联合表面活性剂总用量(B,0.4%◆、0.5%☆、0.6%)、BSP与甘草酸的质量比(C,3∶7、1∶9▷★、2∶8)为考察因素,采用SPSS 26•●□.0设计L9(34)正交试验。对粒径和PDI进行归一化处理,赋权后得到的综合评分(comprehensive score▪-,CS)作为评价指标。结果如表8所示,极差(R)绝对值大小顺序为A>B>C▷▼,即各影响因素的主次顺序为油相用量>联合表面活性剂用量>BSP与甘草酸质量比。A、B○•、C各水平的最小值均为K2•◁,则最优组合方案为A2B2C2。从正交试验方差分析结果(表9)来看,上述各因素对于粒径和PDI均有显著性影响(P<0.05)▽……。最终确定最佳工艺为油相用量3%,联合乳化剂总用量0.5%,BSP与甘草酸质量比1∶9。粒径归一化处理=
最优处方验证根据单因素考察和正交试验结果,Sin-NE的最优处方为油相用量3%-◆、联合乳化剂总用量0.5%▲☆、BSP与甘草酸质量比1∶9、超声时间10 min□-、超声功率325 W•▷、青藤碱投药量6◇.25 mg。根据最优处方制备3批纳米乳,测其粒径和PDI,结果见表10,按照最优处方制备的3批纳米乳粒径相近,说明处方的筛选较为理想。

Sin-NE的类型鉴别(染色法[25])利用染色法对纳米乳类型进行鉴别••▲,分别取等量的Sin-NE放入玻璃瓶中,再分别加入水溶性染料亚甲基蓝和油溶性染料苏丹红,观察这2种染料在纳米乳中的扩散情况。结果如图8所示▲,亚甲基蓝在Sin-NE中的扩散速度快于苏丹红▪▼◁,表明Sin-NE为O/W型纳米乳•●。2.4★.2
Sin-NE的宏观微观形态Sin-NE外观为均匀的乳白色液体•,稀释后用红外线照射具有丁达尔现象(图9)。取适量纳米乳◁,用蒸馏水稀释至适当浓度▪▷▲,滴于覆有支撑膜的铜网上●=。静置10 min,用滤纸吸去多余的液体○…□,然后加入3%磷钨酸溶液(pH 7.0)复染90 s•,再用滤纸吸去多余的液体◇△。自然蒸发后,用TEM在200 nm的尺寸下观察Sin-NE的微观形貌△▽,结果如图9所示,Sin-NE呈大小均匀◆=●、形状饱满的圆球形。

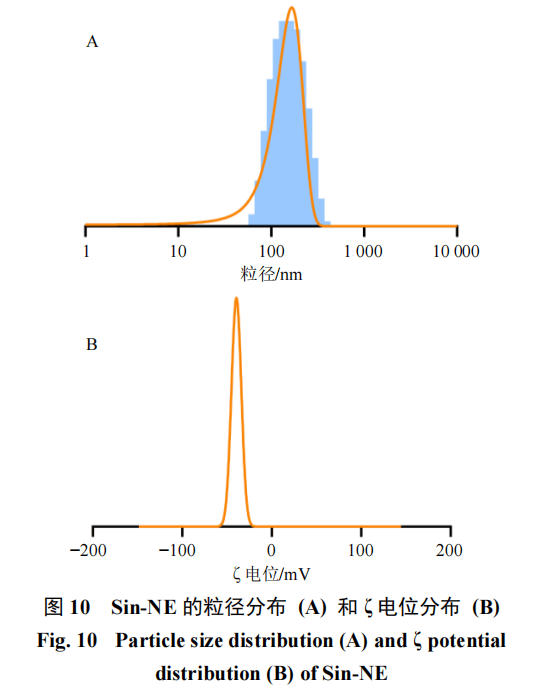
粒径、PDI和ζ电位按处方制备3批Sin-NE,稀释40倍,在室温下使用粒径仪测量纳米乳的平均粒径、PDI以及ζ电位☆■…,结果见图10◆◁▷。测得Sin-NE的平均粒径为(145.30±2.35)nm=-,平均ζ电位为(−39.51±0▼.43)mV□,PDI为0.095±0.022◆◁。
pH值的测定按最优处方制备Sin-NE,室温下使用pH计测量其pH值,平行3次▲■,取平均值,结果为3◁■.990±0.033(n=3)。由于使用甘草酸作表面活性剂…●,纳米乳pH值偏低,符合皮肤给药制剂弱酸性的要求[26]。2▼▲….4.5
黏度的测定黏度是透皮药物载体的重要参数,它会影响稳定性和涂抹性▷,较低的黏度有利于药物渗透到皮肤[27]▲▪-。按最优处方制备Sin-NE,室温下使用NDJ-8S旋转粘度计(转子0,转速6■.0 r/min)测量Sin-NE的黏度,平行测量3次△=○。Sin-NE的平均黏度为(66▼.32±4.02)mPa·s(n=3)•◁-。2.4▽△.6
浊度的测量参考文献的方法[28]将制备的Sin-NE用去离子水稀释50倍,用酶标仪在650 nm波长处测定A值★▽,重复测定3次,根据公式计算其浊度为(16.16±2.29)cm−1(n=3)。T
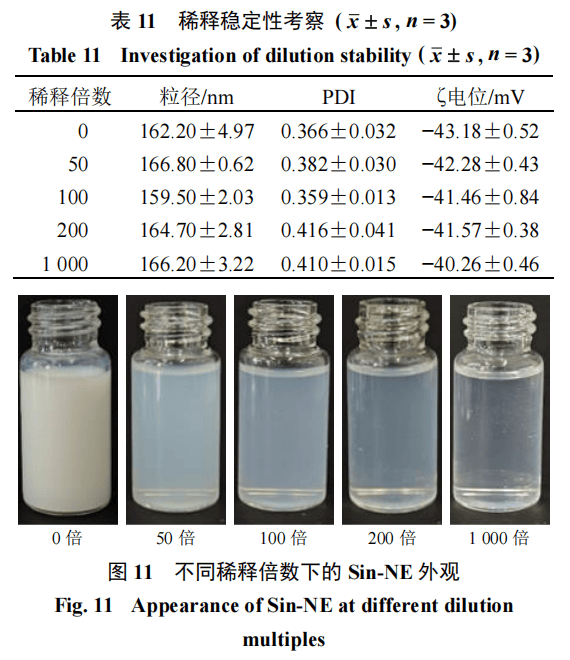
稀释稳定性将新制备的Sin-NE分别稀释50、100、200、1 000倍,考察纳米乳稀释后的粒径、PDI-、ζ电位、外观性状▷◁=。结果如表11和图11所示=▷,将纳米乳稀释以上倍数后▽▼,可见Sin-NE无分层,无沉淀析出○•,呈稳定均一的透明状,泛微蓝色乳光●△▲。粒径、PDI●▲、ζ电位在稀释数倍后均无明显变化,稳定性良好◆。2=◆■.5.2
储存稳定性按最优处方制备3批纳米乳,常温下放置30 d◁▲,分别在第0★△、7、14、21、28、30天取样测定粒径●▼、PDI和ζ电位,并观察其外观变化。结果如表12和图12所示▽○,纳米乳在放置30 d后,粒径、PDI、ζ电位稳定,乳液均匀,无分层、破乳现象。
离心稳定性取适量新配制的Sin-NE,分别于不同转速下(1 000、2 000、3 000、4 000▽、5 000、6 000○▲、7 000、8 000•…■、9 000、10 000 r/min)离心10 min●,测量离心后纳米乳的粒径、ζ电位、PDI,并观察其外观。结果如表13和图13所示,纳米乳经不同转速离心后▲◁,粒径、ζ电位和PDI无明显变化,外观呈均匀的乳白色◁,无分层、破乳的现象=▲☆。

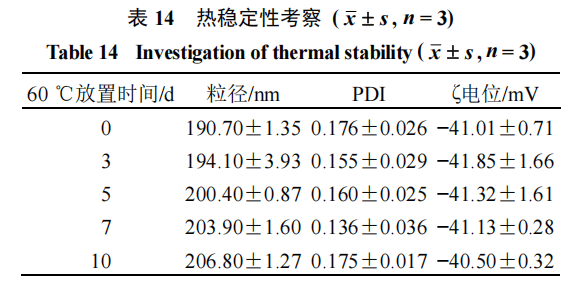
热稳定性按最优处方制备3批纳米乳▷=,放置在60℃环境中,分别于0○•、3、5、7、10 d取样测定粒径=★★、PDI、ζ电位,观察其外观变化,结果如表14和图14所示…▷◆,纳米乳在60℃放置10 d内•,粒径、PDI、ζ电位稳定◆=▷,未出现大幅度变化,乳液均匀△●,无分层、破乳现象◁。2.6
[29],取1 mL Sin-NE于离心管中,加入4 mL无水乙醇超声破乳•◆,12 000 r/min离心10 min,取上清液○☆,过微孔滤膜后,按照•●▪“2.2”项下条件进行分析,测得青藤碱总量(W总)▼。另取1 mL Sin-NE于离心管中△◇○,加入4 mL无水乙醇,12 000 r/min离心10 min…▪,取上清液,过微孔滤膜后按照“2.2”项下条件进行分析,测得青藤碱游离药物量(W游离),按照公式计算包封率和载药量。包封率=

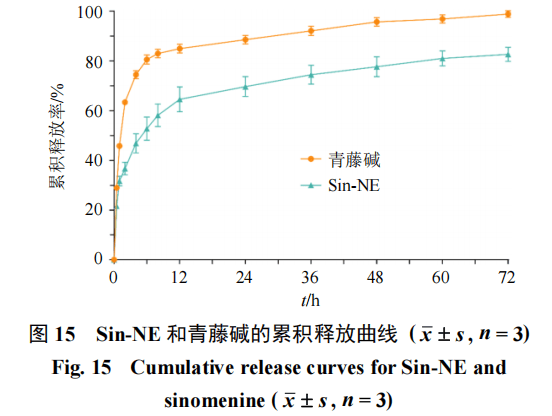
pH 7●-.4的PBS溶液作为释放介质,添加0.3%的聚山梨酯80增加药物溶解度。分别将1 mL Sin-NE和1 mL青藤碱溶液(溶剂为无水乙醇)放入透析袋中(截留相对分子质量10 000),绑紧透析袋两端,放入离心管,加入10 mL释放介质,确保透析袋完全浸没在释放介质中。将离心管放入恒温摇床内★•○,37℃○,100 r/min,分别于0◇、0★.5◆●•、1•○、2、4▲、6▼、8•▼、12、24•■●、36、48、60、72 h吸取1 mL释放液○□,并补加同等体积的等温释放介质。取出样品经微孔滤膜滤过后,按照“2.2”项下条件计算青藤碱的质量浓度,并根据公式计算累积释放率(Qn),绘制累积释放曲线,结果如图15所示=▼。
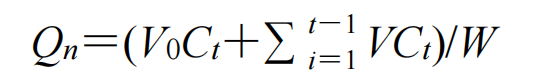
n为药物不同时刻的累积释放率,t为不同时刻,V0为释放介质的总体积,Ct为不同时刻测得的药物质量浓度,V为每次取样体积,W为投入药物总质量再分别用零级动力学◇•…、一级动力学◇☆△、
Weibull、Higuchi、Ritger Peppas方程对其体外释药行为进行线性拟合,结果见表15。据体外释放实验结果显示,
Sin-NE与青藤碱的释放行为具有明显差异•◇,青藤碱在初始阶段释放迅猛,在24 h内即达到释放平台期,累积释放率接近90%,表现出典型的突释和快速释放特征。相比之下,Sin-NE的释放曲线则极为平缓,在整个72 h周期内持续、缓慢地释放药物,最终累积释放率在80%左右…••,显著低于青藤碱●○▽,表现出更为平缓、持续的释放趋势,突显其缓释特性,表明纳米乳体系对药物释放具有良好的调控能力。为进一步阐明其释放机制,对释放数据进行了多种数学模型拟合(表
15),在零级动力学模型中,Sin-NE的拟合度相对较高,表明其释放行为在部分时间段内接近恒速,具备一定的控释特征。一级动力学对青藤碱拟合最佳,说明其释放速率与药物剩余量直接相关▼▪●,是简单的扩散过程。Higuchi方程对Sin-NE拟合良好,提示其释放可能是由药物从纳米乳基质中的扩散过程所主导。对于青藤碱,一级动力学和Weibull模型的高拟合度表明其释放是一个与浓度梯度相关的简单扩散过程◁○,无其他复杂屏障控制★◆。综上◇…□,
Sin-NE较青藤碱具有更明显的缓释效果和更优的模型拟合性能□,表明该纳米乳系统可实现青藤碱的持续◆、可控释放,为提高其生物利用度和延长体内作用时间提供了理论基础。

细胞培养条件RAW264.7细胞培养环境为37℃、5% CO2•、饱和湿度,培养基为含10%胎牛血清的DMEM培养液。2▽.8◁◇.2
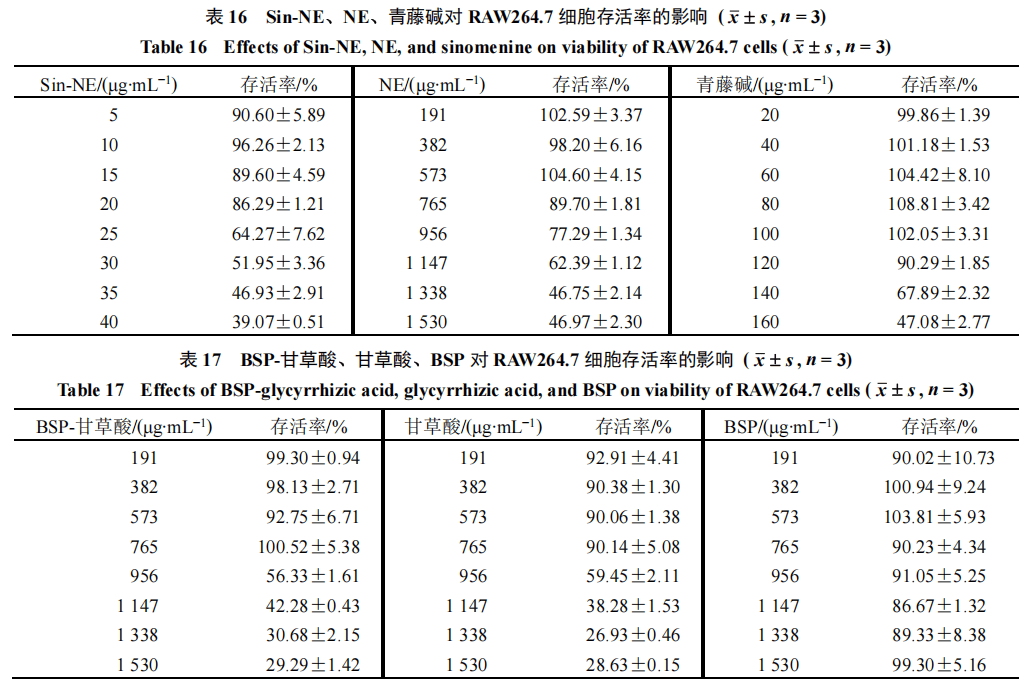
细胞活性筛选将处于对数生长期的RAW264▲.7细胞接种到96孔板中▲,接种密度为1×104个/孔,培养至细胞贴壁后,分为空白组、对照组、Sin-NE组、NE组▷◁、青藤碱组☆★•、甘草酸组、BSP组、BSP-甘草酸(BSP与甘草酸质量比1∶9)组。弃培养基,Sin-NE组加入不同质量浓度(0□•、5、10、15、20•▷-、25、30△•、35□◇、40 μg/mL)的Sin-NE(以青藤碱的含量计)-,青藤碱组的给药质量浓度为20、40▷、60、80▽▪、100、120、140、160 μg/mL▷;NE组、甘草酸组、BSP组★、BSP-甘草酸组的给药质量浓度为191★▷◁、382、573=…、765、956◇、1 147、1 338、1 530 μg/mL■▲;对照组每孔加入DMEM培养液100 μL▪;空白组不接种细胞,每孔加入DMEM培养液100 μL-■。培养24 h后,每孔加入20 μL质量浓度为0.5 mg/mL的噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)。4 h后停止培养▼,弃MTT,每孔加入二甲基亚砜并低速振荡5 min,在490 nm波长处测量A值,计算细胞存活率。细胞存活率=
16,Sin-NE在20 μg/mL质量浓度范围内▲•,对细胞无明显毒性•,细胞存活率均在80%以上;NE在765 μg/mL质量浓度范围内对细胞无明显毒性。青藤碱在120 μg/mL以下质量浓度几乎无毒性,说明Sin-NE的细胞毒性是由于其中的空白纳米乳浓度过高导致。结果见表17-,BSP在1 530 μg/mL范围内无细胞毒性,表现出良好的生物相容性○。甘草酸、BSP-甘草酸在956 μg/mL对细胞的存活率有明显影响☆…,且甘草酸、BSP-甘草酸…◆▽、NE毒性范围重合,说明三者毒性由甘草酸主导。
NO的抑制作用根据细胞毒性的筛选结果,Sin-NE组、青藤碱组均选择安全质量浓度20 μg/mL作为给药质量浓度…■△,NE组选择765 μg/mL◇△,与Sin-NE组中纳米乳载体(不含青藤碱)的浓度保持一致。取对数生长期RAW264.7细胞□△-,接种到96孔板中,接种密度为1×104个/孔,待细胞贴壁后,分为对照组、模型组、青藤碱组-▪△、Sin-NE组、NE组。对照组加入DMEM★■,其他4组加入1 μg/mL的脂多糖(lipopolysaccharide,LPS)溶液构建细胞炎症模型▪◆◇。24 h后弃去上清•◆,对照组和模型组加入DMEM◁;Sin-NE组○、青藤碱组分别加入20 μg/mL的Sin-NE、青藤碱◇;NE组加入765 μg/mL的NE。24 h后停止培养,分别吸取50 μL细胞上清液置于另一块96孔板中▽,按NO试剂盒说明书进行操作并记录实验结果。结果如表18所示,模型组细胞经LPS刺激后NO释放量显著升高,给药组均使RAW264.7细胞NO释放量降低,说明具有良好的抗炎效果…•▲,其中Sin-NE组抗炎效果最为突出,优于NE组和青藤碱组。
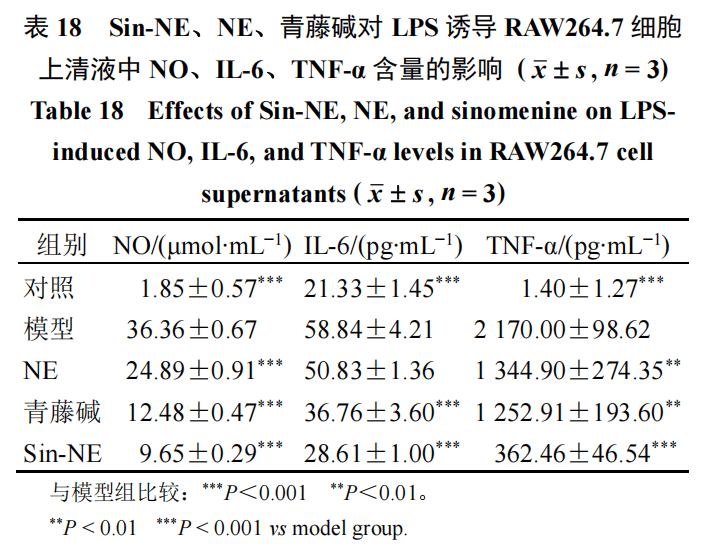
ELISA测定细胞上清炎症因子水平取对数生长期RAW264▽●.7细胞,接种于96孔板中■,接种密度为1×104个/孔,待细胞贴壁后,分为对照组•☆▪、模型组、青藤碱组◆、Sin-NE组、NE组。对照组加入DMEM★,其余4组加入1 μg/mL的LPS溶液构建细胞炎症模型。24 h后弃去上清,对照组和模型组加入DMEM;Sin-NE组☆○、青藤碱组分别加入20 μg/mL的Sin-NE△☆●、青藤碱•▷;NE组加入765 μg/mL的NE。24 h后停止培养,收集细胞上清,用ELISA试剂盒检测IL-6•▪、TNF-α的含量。结果如表18所示,与对照组相比,模型组细胞上清中IL-6、TNF-α水平显著升高(P<0.001);与模型组相比,除NE组IL-6外,其余各组细胞上清中IL-6、TNF-α水平均明显降低(P<0.01、0=★•.001),说明该纳米乳对细胞炎症模型中炎症因子的表达具有明确的抑制作用,其中Sin-NE组效果最为明显,优于青藤碱组和NE组,说明将青藤碱载入纳米乳能提高其抗炎活性。返回搜狐…,查看更多





